|
as partículas de luz de albert einstein
A revolução na Física estava só começando em 1905
ano 3 - n.6 - jul./dez. 2005
por Larissa Perdigão
Um dos artigos de Einstein publicados no ano de 1905 lhe valeu o prêmio Nobel de Física de 1924. Este artigo explicava, de forma revolucionária, o efeito fotoelétrico. Não seria possível a existência dos computadores, das câmeras de fotos e vídeos que não usam filmes fotográficos, das placas de conversão de energia solar em energia elétrica, do laser e suas aplicações, se não se conhecesse o efeito fotoelétrico e sua conseqüência mais impressionante: a luz também pode ser considerada uma partícula, um pulso de energia.
Então, vamos às explicações. O efeito fotoelétrico provoca, entre outras coisas, a descarga elétrica de um eletroscópio de folhas (ver quadro) quando submetido à incidência de luz ultravioleta (UV), luz de alta freqüência. Ou seja, de alguma forma, a luz remove elétrons das folhas metálicas e o eletroscópio é descarregado. Daí vem o nome fotoelétrico: a palavra foto, em grego, significa luz.
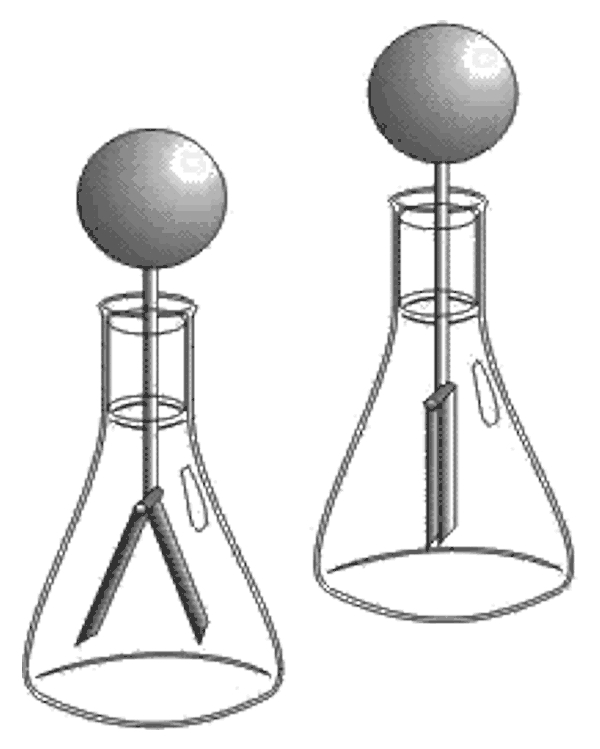
Eletroscópio de folhas
| |
 |
| Eletroscópio carregado e neutro |
O eletroscópio de folhas, visto na figura, é composto por uma garrafa transparente isolante, fechada por uma rolha igualmente isolante. Na parte de cima, uma esfera metálica. No interior, duas finíssimas folhas metálicas, de ouro ou de alumínio.
Se o eletroscópio estiver neutro, suas folhas estarão abaixadas. A aproximação de um corpo carregado à esfera superior induz cargas no sistema, e as folhas se separam, por possuírem cargas de mesmo sinal. Se esse corpo carregado tocar a esfera superior, o eletroscópio também ficará eletricamente carregado.
|
O físico alemão Heinrich Rudolf Hertz (1857-1894) foi o primeiro cientista a confirmar experimentalmente a existência das ondas eletromagnéticas. A luz, então se soube, é um tipo de onda eletromagnética. Hertz foi também o primeiro a registrar o efeito fotoelétrico, ao notar que uma placa metálica liberava elétrons quando iluminada por luz UV.
| Divulgação |
 |
| Philipp Lenard e Niels Bohr |
Hertz morreu prematuramente, mas seu auxiliar, o húngaro Philipp Eduard Anton von Lenard (1862-1947), Nobel de Física em 1905, prosseguindo com as pesquisas, fez algumas observações muito curiosas sobre o efeito fotoelétrico. Nenhuma delas estava de acordo com as teorias da Física clássica. As observações, publicadas em 1900, foram que:
1) O fenômeno só ocorre a partir de uma determinada freqüência de luz, chamada limiar fotoelétrico. Não importa a intensidade da luz: se toda essa luz tiver uma freqüência inferior ao limiar fotoelétrico, o efeito fotoelétrico não é observado. Ou seja, nenhum elétron é liberado pela placa metálica.
2) O número de elétrons emitidos pela placa metálica é diretamente proporcional à intensidade da luz, mas só se essa luz tiver freqüência maior ou igual ao limiar fotoelétrico.
3) A energia cinética e, por conseqüência, a velocidade dos elétrons aumenta com o aumento da freqüência da luz incidente, mas não varia com a variação da intensidade da luz.
Pela teoria clássica, a energia de uma onda é proporcional à sua amplitude (intensidade). Logo, aumentando-se a intensidade da luz, aumentar-se-ia a sua energia e, num determinado momento, essa energia seria suficiente para arrancar elétrons da placa. Pela observação 1, não era isso o que acontecia.
Também era de se esperar que a velocidade de saída dos elétrons fosse dependente da intensidade da luz, o que, pela observação 3, não se confirmou experimentalmente. O aumento da intensidade da luz só aumentava o número de elétrons liberados, mas não a velocidade de cada um, pela observação 2.
Naquele mesmo ano de 1900, outro físico alemão, Max Karl Ernst Ludwig Planck (1858-1947) em uma apresentação na Sociedade Alemã de Física, propôs uma solução interessante para outro fenômeno não explicado pela Física clássica, a radiação térmica: a energia E de uma onda eletromagnética (como a luz, por exemplo) é diretamente proporcional à sua freqüência f. Pela lei matemática hoje utilizada, E = h · f, onde h é a hoje chamada constante de Planck.
Planck afirma, com isso, que a energia é como a matéria e seus átomos: só existe na natureza sob a forma de "pacotes" ou "pulsos" unitários, chamados "quanta". Hoje, estes pulsos são chamados fótons. No entanto, nem mesmo o próprio Planck defendia com ardor a sua própria explicação, por ser baseada unicamente na Matemática e não concordar com nenhuma das teorias da Física clássica.
| Divulgação |
 |
| Max Planck e Albert Einstein |
Em seu artigo de 1905, Einstein fez uso da idéia de Planck para explicar o efeito fotoelétrico. Mas, ao contrário de Planck, que sugeriu a quantização da energia como um "truque matemático" para a explicação de alguns dados experimentais, Einstein propôs que a quantização era uma propriedade fundamental das ondas eletromagnéticas.
Einstein sugeriu que cada fóton, ou seja, cada pulso de luz seria capaz de liberar um elétron do metal, desde que, sozinho, tivesse energia suficiente para isso. As energias dos fótons não se somariam para, juntas, arrancar um elétron. Isto explica a propriedade 1, tratada anteriormente.
A intensidade da luz, segundo o artigo de Einstein, é proporcional ao número de fótons emitidos, o que justifica a propriedade 2.
Finalmente, a energia que "sobra", ou seja, a diferença entre a energia do fóton e a energia necessária para remover o elétron do metal, é convertida em energia cinética do elétron, o que explica a propriedade 3.
A idéia de quantização da energia serviu, nos anos seguintes, para explicar diversos fenômenos "obscuros" da Física na época. Foi usada, igualmente, como uma das bases da equação do físico dinamarquês Niels Bohr para os espectros de emissão atômica (ver quadro), que, desta forma, justificou, entre outras coisas, por que o elétron não "cai" no núcleo.
Uma descoberta deste porte já seria suficiente para consagrar qualquer cientista. Mas Einstein não parou por aí. Trataremos da teoria da relatividade, outra idéia incrivelmente perturbadora de Einstein, também publicada há 100 anos, em uma próxima oportunidade.
| O que são espectros de emissão atômica?
O aquecimento ou a passagem de uma corrente elétrica por um gás provoca a emissão de luz. É o que acontece, por exemplo, nas lâmpadas da iluminação pública. As lâmpadas amareladas contêm sódio no estado gasoso, enquanto as brancas pálidas contêm mercúrio gasoso.
Decompondo-se a luz emitida com o auxílio de um prisma, verifica-se que o espectro (conjunto das cores) obtido não é contínuo. Ao contrário, o gás só emite luz de freqüências muito específicas. O espectro de emissão, em vez de parecer um arco-íris, contém algumas poucas raias, sendo, por este motivo, também chamado espectro de linhas. Até o início do século 20, não havia explicação para esse comportamento.
Niels Henrik David Bohr (1885-1965) sugeriu, então, que as linhas correspondem a fótons emitidos por elétrons que perderam energia em uma transição eletrônica (mudança de camada na nuvem eletrônica do átomo). Como estas camadas possuem energias bem definidas (pela teoria da quantização), a transição eletrônica também deve ocorrer sempre com a liberação ou absorção de energias bem definidas. Estas restrições não permitem que o elétron "caia" no núcleo atômico.
|
|
Cultura Secular
Revista de divulgação científica e cultural do Secular Educacional.
Comissão editorial
Larissa Perdigão
Rodolfo Augusto Vieira
Jornalista responsável
Larissa Perdigão (MTb/SP 37654)
Imprenta
São Carlos, SP, Brasil
ISSN 2446-4759
|
|