|
teorias atômicas: física e química caminhando juntas
Um belo exemplo da maneira como o conhecimento científico se desenvolve
ano 6 - n.12 - jul./dez. 2008
por Larissa Perdigão
| maine.edu |
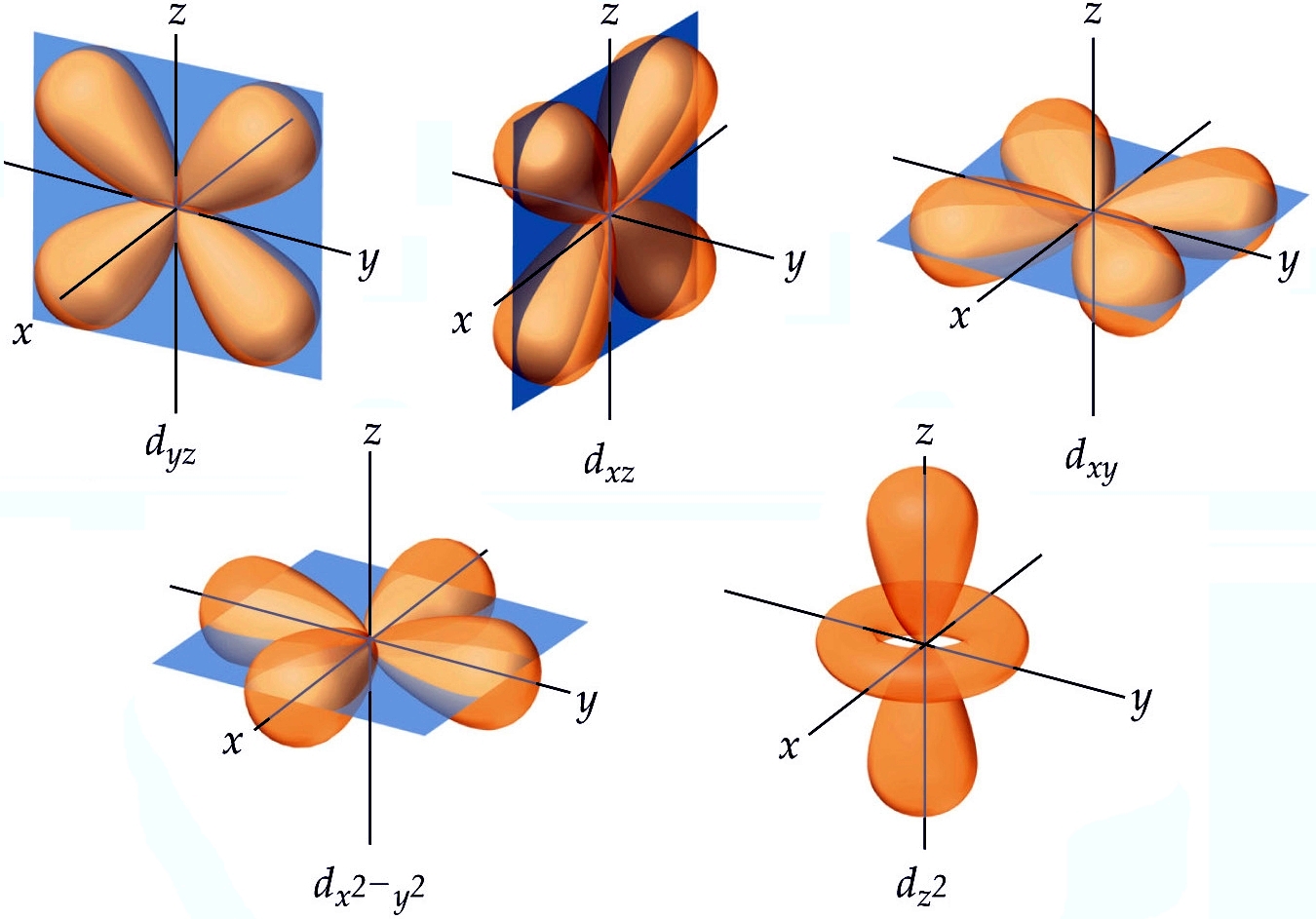 |
| Orbitais do subnível d: origem em funções de onda |
Na Grécia Antiga, discutiu-se pela primeira vez a respeito: o que acontece se dividirmos algum material em pedaços cada vez menores? Há um ponto em que a matéria se torna indivisível ou ela se divide infinitamente? Alguns filósofos acreditaram na existência de minúsculas partículas indivisíveis, chamadas por eles de átomos (do grego a - não e tomo - divisão), enquanto a maioria julgava que a matéria era contínua e poderia ser dividida infinitamente.
A idéia que se tornou mais forte foi, realmente, a da divisão ilimitada, já que, para os gregos antigos, havia apenas quatro "elementos", terra, ar, água e fogo, e que qualquer substância poderia ser formada com a combinação adequada desses elementos. Foi com base nessa crença que os alquimistas passaram séculos buscando transformar metais menos nobres em ouro.
Os primeiros indícios científicos importantes da existência de partículas elementares e indivisíveis, que contrariavam a teoria até então vigente, foram dados pelo químico inglês John Dalton (1766-1844), em 1807. Baseado em uma série de medidas laboratoriais de massas de elementos que se combinavam, ele enunciou as Leis Ponderais das Reações Químicas. Suas leis foram o primeiro argumento convincente da existência dos átomos.
Dalton, sem ter meios de conhecer as características dos átomos, imaginou-os como sendo maciços, indestrutíveis, indivisíveis e homogêneos, como bolas de bilhar. No entanto, no fim do século 19 e início do século 20, novas experiências na área da Física serviram para entendermos, de fato, como é a estrutura do átomo.
Algumas dessas experiências indicaram que o átomo é composto por partículas ainda menores, as partículas subatômicas. A primeira delas foi a do físico britânico Joseph John Thomson (1856-1940), que, aplicando uma alta voltagem sobre um gás a baixa pressão, conseguiu arrancar os elétrons do metal que servia de eletrodo. Esse experimento é considerado como marco da descoberta do elétron.
Com base no experimento de Thomson, alguns cientistas sugeriram outro modelo para o átomo. Para eles, o átomo era maciço e positivo, como um pudim, e possuía cargas elétricas negativas colocadas ao seu redor, como passas. Embora a teoria do "pudim com passas" tenha caído poucos anos depois, o modelo de aparelhagem de Thomson acabou servindo para a descoberta não só dos elétrons, mas também dos prótons, alguns anos depois.
O físico neozelandês Ernest Rutherford (1871-1937), trabalhando com radioatividade, verificou, em 1908, que os átomos não eram maciços. Ele bombardeou uma finíssima lâmina de ouro, de espessura de uns poucos átomos, com partículas alfa, que são, grosso modo, núcleos atômicos do elemento hélio. A maior parte das partículas atravessou a folha, com desvio baixíssimo ou nenhum desvio, o que o levou a crer que a maior parte do átomo é vazio, derrubando, assim, a teoria dos seguidores de Thomson.
Poucos anos depois, o físico dinamarquês Niels Bohr (1885-1962), baseado também em experimentos de transição eletrônica, propôs que os elétrons giravam em órbitas definidas (quantizadas) ao redor do núcleo, e que eles não perdiam energia nesse movimento, como planetas ao redor do Sol. Já que não perdem energia, os elétrons não caem no núcleo. O modelo atômico de Rutherford-Bohr é bastante semelhante ao atual. A única diferença está na distribuição dos elétrons ao redor do núcleo. A idéia de órbitas definidas foi substituída pela teoria de orbitais.
Desde o fim do século 19, muitas pesquisas em física começaram a dar resultados inesperados, não previstos pelas teorias da mecânica clássica. A única explicação possível foi a de que, assim como a matéria, que é composta de partículas elementares e indivisíveis, também a energia só pode ser transferida em múltiplos de uma pequena quantidade determinada. Desenvolveram-se, a partir daí, as teorias da mecânica quântica.
Entre os mais importantes estudos e teorias quânticas que são aplicados aos elétrons estão: a dualidade partícula-onda, do francês Louis de Broglie, que afirma que ondas possuem aspectos corpusculares e vice-versa; o princípio da incerteza do alemão Werner Heisenberg, que diz ser impossível determinar simultaneamente a velocidade e a localização de uma partícula; e as equações de onda do austríaco Erwin Schrödinger, que descrevem as partículas em termos da mecânica quântica, ou seja, descrevem os orbitais.
Orbitais são regiões da eletrosfera onde a probabilidade de se encontrar o elétron é maior. Essa probabilidade é, geralmente, alta, mas nunca de 100%. Ou seja, nunca podemos determinar a localização exata de um elétron, mas podemos, sim, determinar a sua localização provável. Niels Bohr desconhecia o fato, e, por isso, propôs as órbitas circulares para os elétrons. Isto não é aceito na mecânica quântica.
Com base nas teorias quânticas, elaboradas por físicos, foram formuladas muitas outras teorias. Entre elas, as que descrevem ligações químicas, geometria de moléculas e transições eletrônicas, o que proporcionou um enorme salto no desenvolvimento da Química e mostra que as ciências são complementares umas às outras.
|
Cultura Secular
Revista de divulgação científica e cultural do Secular Educacional.
Comissão editorial
Larissa Perdigão
Michelle Zampieri Ipolito
Jornalista responsável
Larissa Perdigão (MTb/SP 37654)
Imprenta
São Carlos, SP, Brasil
ISSN 2446-4759
|
|