|
oxigênio e lei da conservação de massas
A descoberta do oxigênio e a lei de Lavoisier estão mais relacionadas do que se imagina
ano 7 - n.13 - jan./jun. 2009
por Larissa Perdigão
| Divulgação |
 |
| Priestley e Lavoisier: um descobriu, o outro entendeu |
Haveria vida na Terra se não houvesse oxigênio? Provavelmente, sim, pois existem muitos microrganismos que não precisam desse gás para sobreviver. Mas certamente nenhuma forma mais evoluída existiria, como vegetais ou animais. Aliás, os vegetais também precisam de oxigênio. Lembre-se de que as plantas respiram oxigênio, não apenas absorvem luz e gás carbônico durante a fotossíntese.
Os animais necessitam de grandes quantidades de oxigênio para aproveitar a energia contida nos alimentos que consome. Quando os animais não conseguem levar oxigênio rapidamente aos músculos, por exemplo, num esforço intenso e repentino, a queima dos alimentos não produz nem 10% da energia que poderia produzir caso houvesse oxigênio suficiente. Além disso, o oxigênio é fundamental para o crescimento do corpo e o funcionamento do cérebro.
O elemento oxigênio, cujos átomos se combinam dois a dois para formar o gás oxigênio, também se combina em trio, gerando o ozônio, um gás que se forma nas camadas mais altas da atmosfera, e que impede que a danosa radiação ultravioleta chegue à superfície. O elemento oxigênio também está presente na água. E a água, ao contrário do gás oxigênio, é fundamental para todos os organismos vivos da Terra.
O fogo também depende do oxigênio para existir. Quando as substâncias se queimam, elas estão, na verdade, se combinando com o oxigênio da atmosfera. Na Antigüidade, o fogo era considerado um dos quatro "elementos fundamentais", juntamente com a água, a terra e o ar. Observando que as chamas sempre parecem estar saindo de um objeto em combustão, os antigos acreditavam que o fogo provocava a saída de alguma substância desse objeto, substância essa que seria fundamental para a queima de qualquer coisa.
Em 1702, o médico alemão Georg Stahl, utilizando os mesmos conceitos que os antigos, deu nome a essa substância: flogístico. Essa teoria, que hoje se revela absurda, explicava por que materiais como a madeira pesavam menos depois de queimados. No entanto, não explicava por que alguns metais tinham comportamento inverso, ou seja, suas massas aumentavam quando eram aquecidos por muito tempo.
O químico inglês Joseph Priestley, mais de 60 anos depois, começou a fazer experimentos com gases. Foi ele quem inventou a água tônica, ao misturar o gás resultante da fermentação da cerveja (hoje conhecido como gás carbônico, CO2) na água. Priestley acabou descobrindo muitos outros gases, como o cloreto de hidrogênio, HCl (que, dissolvido na água, resulta no ácido clorídrico) e o óxido nitroso, N2O, anestésico, conhecido como gás do riso.
Priestley também foi um dos descobridores do gás oxigênio. Ele percebeu que, durante o aquecimento do óxido mercúrico, Hg2O2, em um recipiente fechado, havia a liberação de um gás que tornava uma chama de vela muito mais brilhante. Além disso, ratos sobreviviam por muito mais tempo num ambiente totalmente fechado quando todo o ar do ambiente era substituído por esse gás. O próprio Priestley respirou esse gás e escreveu que, até aquele momento, apenas ele e seus ratos haviam feito isso, mostrando desconhecer que o gás era o oxigênio, que ele respirou por toda a sua vida. A reação ocorrida, na linguagem química utilizada atualmente, é a seguinte:
Esse desconhecimento de Priestley o levou a interpretar os resultados obtidos de acordo com a teoria do flogístico. Segundo ele, o aquecimento do óxido mercúrico retirava flogístico do ar. Por isso, a queima da vela e a respiração dos ratos ocorria mais facilmente, já que havia mais espaço para o flogístico liberado pela combustão e pela respiração. Complicado, não?
O problema de Priestley foi que ele tentou explicar o novo fenômeno usando uma teoria antiga, e não tentou elaborar uma nova. Antoine Lavoisier, químico francês que viveu à mesma época de Priestley, elaborou uma nova teoria. A simplicidade de sua idéia fez desaparecer a teoria do flogístico, principalmente depois que novas observações científicas foram sendo feitas.
Priestley foi a Paris logo depois dessa experiência com o óxido de mercúrio, e assim contou a Lavoisier detalhes da pesquisa. O químico francês já fazia pesquisas com o aquecimento de diversas substâncias. Ele sabia que o óxido mercúrico perdia massa quando aquecido, mas que substâncias como o fósforo ganhavam massa no aquecimento.
| |
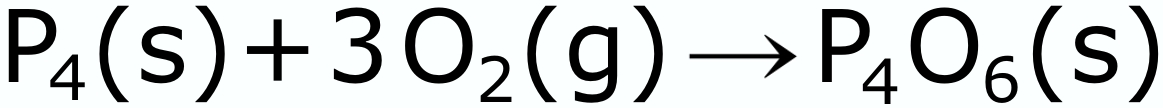 |
| Reação do fósforo branco com o oxigênio do ar. Na queima, o fósforo ganha seis átomos de oxigênio e fica mais pesado. |
Lavoisier estava certo ao acreditar que isso acontecia porque algumas substâncias reagiam com o ar, consumindo-o, enquanto outras liberavam gases. Ele conseguiu demonstrar que a reação inversa à feita por Priestley, ou seja, a produção de óxido mercúrico a partir de mercúrio metálico, só acontecia na presença de ar, e que este ar perdia sua capacidade de queimar velas após a reação. O cientista francês deu a esse componente do ar o nome de oxigênio (do grego "produzir um ácido"). Isto porque Lavoisier erradamente acreditava que o oxigênio estava presente em todos os ácidos.
Lavoisier também percebeu que não havia variação na massa total do sistema substância-ar. Ou seja, quando a substância perdia massa, o ar ganhava exatamente a mesma massa. Isto o levou a formular a Lei de Conservação de Massas, que afirma que "em toda transformação, uma quantidade igual de matéria existe antes e depois dessa transformação". Ou, na frase que se popularizou: "Na natureza nada se cria, nada se perde: tudo se transforma".
O francês Lavoisier é considerado o Pai da Química. Ele publicou suas idéias a respeito da química em 1789, num livro intitulado Tratado Elementar de Química. Além da linguagem simples, seu livro se destacou por introduzir nomenclaturas e novas bases científicas, o que, na prática, transformou a química de simples curiosidade em uma ciência de verdade.
|
Cultura Secular
Revista de divulgação científica e cultural do Secular Educacional.
Comissão editorial
Larissa Perdigão
Michelle Zampieri Ipolito
Jornalista responsável
Larissa Perdigão (MTb/SP 37654)
Imprenta
São Carlos, SP, Brasil
ISSN 2446-4759
|
|